Pripremamo se za ispit u hemiji. Prezentacija. Izražajno iskustvo u pripremi za OGE i EGE u hemiji Teme upravljačkih radova uključenih u priručnik
VAŠAO VAŠU PAŽNJU Izbor testnih zadataka za pripremu za EEG-2016. Zadaci 1. dijela 1, br .32 o provjerljivom elementu sadržaja kursa hemije "karakteristična hemijska svojstva neorganskih tvari". Materijal sadrži 27 testnih zadataka. Odgovori su priloženi.
VAŠAO VAŠU PAŽNJU Izbor testnih zadataka za pripremu za EEG-2016. Zadaci tipa A15 na tečaju hemikalija u karakterističnim hemijskim svojstvima aldehida, ograničiti karboksilne kiseline, estere. Biološki važne tvari: masti, ugljikohidrati (monosaharidi, disačari, polisaharidi). " Materijal sadrži 30 testnih zadataka. Odgovori su priloženi.
Ciljna publika: za 11. razred
Edukativni resurs namijenjen je diplomiranim diplomima glavne i srednje škole koji su odabrali ispit na temu "hemije". Sadrži teorijski materijal prema navedenoj temi. Postoje zadaci samo-konsolidacije teorijskog materijala i kontrolnog testa. Takođe možete koristiti u procesu nastave tema u 9.11 časovima.

Ciljana publika: za učitelja
VAŠAO VAŠU PAŽNJU Izbor testnih zadataka za pripremu za EEG-2016. Zadaci tipa A14 na hemijskom toku hemikalija u hemijskim svojstvima ograničavajućih monohirednih i polihidričnih alkohola, fenola. Materijal sadrži 25 testnih zadataka. Odgovori su priloženi.
Ciljna publika: za 11. razred
VAŠAO VAŠU PAŽNJU Izbor testnih zadataka za pripremu za EEG-2016. Zadaci tipa A13 na kursu hemije u elementu hemijskog sadržaja "Karakteristična hemijska svojstva ugljovodonika: alkane, cikloalkeni, alkene, davniji, alkini, aromatični ugljikovodici (benzen, toluen)." Materijal sadrži 25 testnih zadataka. Odgovori su priloženi.
Ciljna publika: za 11. razred
Priručnik je namijenjen izradu praktičnih vještina i vještina učenja prilikom pripreme za upotrebu. U radu se prikazuje primjeri opcija za zadatke C1, C2 sa odgovorima. Kao i lanci transformacija na primjeru alkalnih metala i njihovih veza sa odgovorima, zadacima s otopinom. Priručnik je namijenjen za nastavnike učenje 11 klasa.
Ciljna publika: za 11. razred
Nchimia zauzima važno mjesto u školskom sistemu.
Prilikom proučavanja hemije, uglavnom se koristi opisni dio tečaja. Kvantitativni obrasci se ne smatraju sistematski. Sposobnost rješavanja zadataka namire jedan je od pokazatelja razine razvoja hemijskog mišljenja školarca.
Ako nema dovoljno pažnje da obratite pažnju na ovo važno pitanje, kao test testovi, Olimpijada, predstojeći ispiti pokazuju, studenti slabo rješavaju zadatke naseljavanja u hemiji.
Izlaz iz položaja je ispravna upotreba zadataka u procesu učenja. Nevažeća epizodna priroda učenja za rješavanje zadataka namire.


Ciljna publika: za 11. razred
Dmitrij Yuryevich Dobrotin, S.N.S. Laboratorija za didaktiku hemiju ISMO RAO, dr. Sc. web stranica
Slide 2.
Struktura školskog hemijskog obrazovanja
1. Propedetska faza (1 - 7 klasa) 2. Glavna (osnovna) obuka učenika u hemiji (8 - 9 klasa) 3. Obuka profila studenata u hemiji (10 - 11 klasa)
Slide 3.
Propedeutatska faza
Svjetska okruženje (1-4 ocjene) STUDIJE OKOLIŠA (5. razred) Prirodna nauka (5, 6, 7 klasa) Fizika i hemija (5 - 6 klasa) Uvod u hemiju (ocjena 7)
Slide 4.
Rezervirajte za čitanje
Izračunato za djecu 6 -12 godina
Slide 5.
Osnovne ideje knjige
Kako je svijet? Metode znanja o prirodi supstanci oko američkih reakcija oko američke kućanske hemijske pismenosti
Slide 6.
Osnovna škola
Kontrolni rad u tematskim provjerama novog formata u hemiji za 8. razred
Slide 7.
Teme testnog rada uključene u priručnik
1. Početni hemijski koncepti 2. Kiseonik. Oksidi 3. vodonik. Voda. Rješenja 4. Osnovne klase anorganskih spojeva 5. Periodični zakon i periodični sistem hemijskih elemenata D.I. Remeeleeva. Hemijska komunikacija 6. Završni test
Slide 8.
Državna konačna certifikacija maturanta u novom obliku u hemiji
O novom obliku državnog konačnog certifikata u 9. razredu u hemijskim preporukama za pripremu GIA u hemijskim zadacima za neovisni rad na informativnim blokovima Mogućnosti obuke odgovora na zadatke kodifikatora
Slajd 9.
Srednja škola
Ege. Univerzalni materijali za pripremu učenika Jedinstveni državni ispit Preporuke za pripreme za EEH u hemijskom zadatku za nezavisne radove na substractory blokovima Opcije obuke Odgovori na plan za demonstraciju posla Plan ispitivanja
Slide 11.
Objavljivanje koristi "Intelekltiran centar"
Dizajniran za upotrebu u svim fazama hemijske pripreme učenika, uključene u priručnike, usmjereni su na provjeru znanja i vještina, čija je masteriranje predviđene obaveznim minimumom i zahtjevima za obuku diplomiranja u bilo kojem CMD-u Hemija kao didaktički materijali omogućavaju izradu materijala različitih nivoa. Poteškoće odražavaju logiku obrazloženja prilikom obavljanja zadataka različitih vrsta i nivoa složenosti omogućavaju da izgradite pojedinu putanju u pripremi za kontrolu mjera, uključujući GIA i Ege
Pogledajte sve slajdove
Brattyakov S.B.
Priprema za upotrebu u hemiji Zadaci 1. dio, 2. dio

Brattyakov S.B.
Ciljevi:
- Pročitajte materijal ispitivanja u hemiji.
- Provjerite svoju spremnost za ispit.
- Proširite iskustvo obavljanja testnih zadataka za hemiju

Prezentacija predstavlja zadatke dva dijela:
- Da biste odabrali tačan odgovor na pitanje miša 1. dijela na odabrani odgovor i kliknite na lijevu tipku miša, riječ "desno" pojavit će se ako se pojavi riječ "pogrešna", s pogrešnim - "pogrešno"
Klikom će se klikovati odgovori i rješenja zadataka dela 2
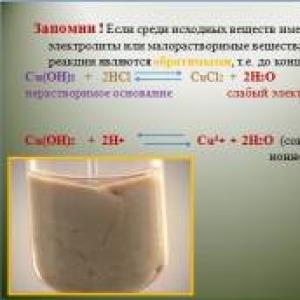
Mendeleev tablica
Tabela rastvorljivosti

Brattyakov S.B.
Da li su sljedeće prosudbe o sintezi metanola i amonijaka u industriji?
SVEDOK ŠEŠELJ - ODGOVOR: Methanol i streljiva streljiva streljiva. B. U proizvodnji metanola i amonijaka primijenjene cirkulacije
1) Obje presude su istinite
Pravo
2) Konscinacije su netačne
Pogrešno
3) Samo samo B.
Pogrešno
4) TRUE samo A.
Pogrešno

Brattyakov S.B.
Koju masu kalcijum oksida mora biti poduzeti za pripremu 200 g rješenja kalcijuma hidroksida s masovnim djelom od 3,7%?
1) 2,8 g
Pogrešno
2) 4.2 g
Pogrešno
Pravo
3) 5,6 g
4) 8,4 g
Pogrešno

Brattyakov S.B.
Kao rezultat reakcije, termohemijske jednadžbe od kojeg
2s 2 N. 2 + 5o. 2 \u003d 4CO 2 + 2N 2 O + 2610 kj.
652.5 KJ toplo.
Zapremina izgorenog acetilena je jednak
1) 33.6 L.
Pogrešno
2) 22.4 L.
Pogrešno
Pravo
3) 11.2 L.
4) 5.6 L.
Pogrešno

Brattyakov S.B.
Koliko će se kisika bit tražiti za katalitičku oksidaciju 100 l sumpornog oksida (iv) do sumpornog oksida (vi)? Volumeni na plinu mjere se u istim uvjetima
Pravo
Pogrešno
Pogrešno
Pogrešno

Postavite dopisnost između imena tvari i klase (grupe) anorganskih veza na koje pripada
Brattyakov S.B.
naziv supstance
veze klase
- A) ch 3 Och. 3
- B) Hoch 2 Ch 2 Ch 3
- C) hcoch 2 Ch 3
- D) ch 3 C (oh) 2 Ch 3
- 1) alken
- 2) pojedinačni gumbi
- 3) poliatomski alkohol
- 4) Easy Eter
- 5) ester
Pogrešno
Pravo
Pogrešno
Pogrešno

Postavite dopisnost između imena tvari i stupnja ugljičnog oksidacije
Brattyakov S.B.
tvari stupanj oksidacije S.
A) Metanol 1) –4
B) metanska kiselina 2) -3
C) metan 3) –2
D) etan 4) 0
Pogrešno
Pogrešno
Pogrešno
Pravo

Podesite dopisnost između tvari i proizvoda na anodi sa elektrolizom svog rješenja
Brattyakov S.B.
soloi Formula proizvod na anodi
A) na. 2 Co. 3 1) H. 2 S.
B) na. 2 S 2) cu
C) Nano. 3 3) O. 2
D) CUCL 2 4) Cl. 2
6) Co. 2
Pogrešno
Pravo
Pogrešno
Pogrešno

Instalirajte dopisnost između formule soli i njegove sposobnosti hidrolize.
Brattyakov S.B.
odnos prema hidrolizi
1) po kationtu
soloi Formula
1) al 2 S. 3
2) anion
3) u kationima i anioni
2) K. 2 Dakle. 3
4) Hidroliza nije izložena
3) Crcl 3
4) K. 2 Dakle. 4
Pogrešno
Pravo
Pogrešno
Pogrešno

Instalirajte prepisku između reakcije reakcije i proizvoda
Brattyakov S.B.
Proizvodi
1) saso 3
2) saso 3 + N. 2 O
3) SA (NSO 3 ) 2
4) SA (NSO 3 ) 2 + N. 2 O
5) CO + N 2
6) N. 2 Co. 3
Reagensi
A) s 2 + N. 2 O
B) s 2 + SAO
C) s 2 + SA (on) 2
D) s 2 (IzK) + SA (HE) 2
Pogrešno
Pogrešno
Pogrešno
Pravo

Brattyakov S.B.
Instalirajte prepisku između dvije tvari i reagensa, sa kojim možete razlikovati ove tvari:
Prava supstanca
A) butanone-2 i etanol 1) HCl (RR)
B) hexen-1 i etil formata 2) FECL 3 (voda)
C) Anilin i fenol 3) br 2 (voda.)
D) benzen i anilin 4) na
5) HNO. 3
Pogrešno
Pravo
Pogrešno
Pogrešno

I za benzenu i stirenu karakteristiku
Brattyakov S.B.
1) Prisutnost u molekuli konjugiranog elektronskog sistema
2) Sp. 3 -Hypebridizacija ugljičnih atoma
3) Interakcija sa vodonikom u prisustvu katalizatora
4) diskoloracija birome vode
5) smreka
6) Dobra rastvorljivost u vodi
Pogrešno
Pogrešno
Pravo
Pogrešno

Metanol ulazi u reakciju sa
Brattyakov S.B.
- Ch 3 Cool
- Naoh.
- Ag 2 O (nh 3 )
- Br. 2 (H. 2 O)
- KMNO. 4 (H +)
Pogrešno
Pravo
Pogrešno
Pogrešno

I anilin, a dimetilamin reagiraju sa
Brattyakov S.B.
1 ) Voda
2) Bromoetan
3) sumporna kiselina
4) bromomodorod
5) natrijum hidroksid
6) Rješenje kalijskog permanganata
Pogrešno
Pogrešno
Pravo
Pogrešno
 N +2 oksidirajuće sredstvo 2i - + 2E - - i 2 Smanjenje agenta "Width \u003d" 640 "
N +2 oksidirajuće sredstvo 2i - + 2E - - i 2 Smanjenje agenta "Width \u003d" 640 " Brattyakov S.B.
30. Korištenje metode elektronskog bilansa, napravite reakcijsku jednadžbu:
Nano. 2 + Nai + ... \u003d ne + ... + na 2 Dakle. 4 +...
Odredite oksidirajuće sredstvo i smanjujući agent.
Odgovor: 2nano. 2 + 2Ai + 2h 2 Dakle. 4 \u003d 2NO + I 2 + 2na. 2 Dakle. 4 + 2h. 2 O.
N. +3 + E. - - N. +2 oksidirajući agent
2i. - + 2e. - - I. 2 smanjenje agenta

31. Bakar je rastvoren u koncentriranoj sumpornoj kiselini. Rezultirajuća sol tretirana je viškom otopinom natrijum hidroksida.
Fliet Blue talog filtriran je i kalciptiran. Zatim je rezultirala supstanca kalcinirana ugljem.
Pišite jednadžbe četiri opisane reakcije .
Brattyakov S.B.
Odgovor: 1) Cu + 2h 2 Dakle. 4 Conc. \u003d Cuso. 4 + Dakle. 2 + 2h. 2 O.
2) CUSO. 4 + 2Aoh \u003d na 2 Dakle. 4 + CU (oh) 2
3) Cu (oh) 2 \u003d Cuo + h 2 O.
4) 2Cuo + C \u003d 2CU + CO 2

32. Napišite reakcijske jednadžbe pomoću koje se mogu izvršiti sljedeće transformacije. .
Brattyakov S.B.
(+ H. 2 O) 1500. 0 Sa Sakkom. t. 0 (+ Br. 2 ), Albr. 3 (+ NH. 3 ), T. 0 P.
Al 4 C. 3 → H. 1 → H. 2 → H. 3 → H. 4 → X. 5
Al 4 C. 3 + 12h. 2 O → 3ch. 4 + 4AL (oh) 3
2ch 4 → C. 2 H. 2 + 3h. 2
3c. 2 H. 2 → C. 6 H. 6
C. 6 H. 6 + Br. 2 → C. 6 H. 5 BR + HBR
C. 6 H. 5 BR + 3NH 3 → C. 6 H. 2 BR (nh. 2 ) 3 + 3h. 2

33. Vodovotni sulfid odlikuje se interakcijom viška koncentrirane sumporne kiseline sa 1,44 g magnezijuma, proslijeđenim putem 160 g 1,5% bromskog rješenja. Odrediti masu talog
Brattyakov S.B.
1) 5h 2 Dakle. 4CON. + 4mg \u003d 4mgso 4 + H. 2 S + 4h. 2 O.
Br. 2 + H. 2 S \u003d 2HBR + S
2) n (mg) \u003d 1,44 / 24 \u003d 0,06 (krtica)
n (H. 2 S) \u003d 0,015 (krtica)
n (br. 2 ) \u003d 160⋅0.015 / 160 \u003d 0,015 (krtica) (obje tvari u potpunosti reagiraju)
3) n (h 2 S) \u003d n (br 2 ) \u003d n (s) \u003d 0,015 (mol)
m (s) \u003d 32g / mol 0,015 mol \u003d 0,48g
Odgovor: Masa sedimenata \u003d 0,48

34. Sa interakcijom od 11,6 g ograničenja aldehida sa viškom bakra hidroksida (ii), talog je formiran težinom od 28,8 g. Pozicija molekularne formule aldehide. Snimite strukturnu formulu i reakcijsku jednadžbu
Brattyakov S.B.
1) S. n. H. 2N. O + CU (oh) 2 \u003d S. n. H. 2n + 1. O. 2 + H. 2 O + CU. 2 O.
2) n (cu 2 O) \u003d 28,8 / 144 \u003d 0,2 (MOL)
n (cu. 2 O) \u003d n (sa n. H. 2N. O) \u003d 0,2 mol
GOSPOĐA. n. H. 2N. O) \u003d 11.6 / 0.2 \u003d 58 g / mol
3) m (sa n. H. 2N. O) \u003d 12n + 2n + 16 \u003d 58
14N + 16 \u003d 58, 14N \u003d 42, N \u003d 3
Molekularna formula - C 3 H. 6 O - propanel

Brattyakov S.B.

Brattyakov S.B.

Brattyakov S.B.
Literatura:
1 . Otvoreni zadaci banke EGE http://www.fipi.ru/os11/xmodules/qprint/afrms.php?proj. =
2. http://chem.reshuege.ru/test?theme\u003d20.
3. http://www.otbet.ru/ege/demo-varianty-ege/demo-himiya/
4. O.S. Gabrielyan. Hemija razreda 10. Butard. M. 2012.
5. O.S. Gabrielyan. Hemija razreda 11. Butard. M. 2012.
6. Predložak Alekseeva L.A.
Faze pripreme studenata na ispit u hemiji P / PP / N Stage Sadržaj Period 1 Formiranje: Interes za predmet i motivaciju njegove studije; Snažno osnovno znanje; vještine za rad samostalno s literaturom, sustavno se bave rješenjem zadataka; Veštine rade sa testovima različitih vrsta. 8-9 klasa

Faze pripreme studenata na ispitu u hemiji P / PP / N Sadržaj sa sadržajem 2 Profilna orijentacija studenata koji određuju krug objekata za koje se priprema za ispitivanje grupe studenata treba pripremiti za ispit u hemiji 9-10

Faze pripreme studenata za ispit u hemiji P / PP / N Sadržaj sa sadržajem 3 Detaljna priprema grupe studenata u hemiji: Diferencirani pristup u predavama Pojedinačne konsultacije

Faze studenata obuke za ispit u hemiji P / PP / N Stage Stage Sadržaj Period 4 Direktna priprema za ispit: Upoznavanje sa strukturom Kim u hemiji, regulatornim dokumentima; Raspodjela posebno teških tema, izbor zadataka različitog nivoa složenosti na ovim temama; Studiranje materijala na temama, dok: - ponavljanje teorije; - Nezavisni rad sa zadacima Ege-a koji se odnosi na ovu temu; - Analiza svih neshvatljivih i nerešenih. 11. razred


Rad sa roditeljima svrha rada: svijest o njima dijelom činjenice da su u cilju realizacije životnih ciljeva svoje djece trebaju dubinsku prirodnu naučnu obuku. Federalni standard osnovnog nivoa ne predviđa svoju svrhu pripreme studenata za prijem na Univerzitet u ovoj oblasti. Student koji odabire ovaj ispit trebao bi planirati veliku količinu neovisnog rada na temi. Da skrene pažnju roditelja na ulogu njihove pomoći u pripremi svoje djece. Nastavnik također mora reći i za pomoć u kojoj je u stanju pružiti učenike u svom radu (materijali, konsultacije).

Diferencirani pristup u pripremama predavanja za ispit male grupe studenata. Učitelj mora pripremiti zadatke višeg nivoa, zadataka u formatu Ege-a. Učitelj nudi dodatni besplatni domaći zadatak. Privlačenje ovih učenika kao asistenta učitelja, udžbenike u organiziranje međusobnog obrazovanja i međusobne kontrole u obrazovnom procesu.

Nezavisni rad učenika dio testova za samostalni rad može se dati studentima sa gotovim odgovorima. Izvođenje takvih testova, student provjerava svoje odgovore "ključem", bilježi greške. Tada ih mora analizirati. Posebna ikona označene greške koje su napravili nepažljive, posebne - one koje su uspjele popraviti uz pomoć priručnika, posebne - one koje student ne može razumjeti. Rezultati ovog učenika za analizu pokazuju učitelja na savetama za razgovore ili u bilo kojem pogodnom vremenu. Moguće su kontrolne testove koji se provjeravaju izravno po savjetovanju.

Metode korištenja testera u časovima za uspješan rad na ispitu i o drugim vrstama kontrole u sličnom formatu, studenti bi trebali znati glavne vrste testnih zadataka, orijentirati u njihovu strukturu, kako bi shvatili kakav oblik treba dati svoj odgovor. U testu, posebno kratko, uvijek postoji mogućnost dobijanja nezaslužene procjene pogađanjem. Kada ih koristite, oralni i pisani govor učenika nisu razvijeni.

Metode korištenja testera u predavanju rada sa testovima - "Odgovor sa komentarima": učenik, usmeno ili u pisanom obliku obavljajući test testa, ne ukazuje samo na tačan odgovor, ali komentari na njega daje motivaciju svog izbora . Verbalno objašnjenje zasnovano na svojstvima određene klase tvari, formulaciji definicije, pravilo, zakon, priprema reakcijske jednadžbe, rješenje zadatka za namirenje treba motivirati.

Značajke obuke Snažne studente Svrha pripreme za EE za snažne studente savladava vještine najsloženijih zadataka S. S. Međutim, moraju se redovno trenirati o ispunjavanju zadataka dionice A i V. u ovom slučaju , zadaci su postavljeni pred njima: a) Minimizira greške koje dopušta nepažljive; b) Opustite teme hemijskog tečaja, gde su greške dozvoljene za neznanje, proučite ove odeljke, da biste izvršili znanje stečene na tematskim testovima.

Priprema slabih i srednjih studenata fokusirana je na uspješnu predaju upotrebe barem za zadovoljavajuću ocjenu. Za to, dovoljno uvjeren u obavljanju dijela kontrole i mjernog materijala (30 primarnih točaka, koji se može upisati u dijelu A, približno odgovara 50 bodova na skali upotrebe). Priprema Potrebno je voditi prema najokrutnijim svojstvima tvari, najčešćim vrstama reakcija, najlakši i najčešće korišteni algoritmi za rješavanje problema.

Strategija rada na ispitivanju pravila prvog kruga: napominje istinito i propuštaju kompleks. (45min.) Pravila drugog raspona: Provjera učinjenih, bacaju pogrešnu, koriste "tri varanja" i hemijskih zakona. (95min. ) Treće pravilo kruga: Provjerite i pogodite čekajući.


Slajd 1.
Klade 2.
 GIA-2010. Ispit u novom obliku. Hemija. 9. razreda / FIPI Autori prevodilaca: A.A. Kaverina, D.YU. Doblotin - m.: Astrel, 2009. Država konačna certifikacija (na novom obliku): 9. razred. Tematski zadaci obuke. Chemistry / Fipi Autor Comiler: D.YU. Doblotin - m.: Eksmo, 2009. Jedinstveni državni ispit 2010. Hemija. Materijali za obuku za obuku studenata / Fiii autori-prevoditelji: yu.n. Medvedev, A.A.KAVERYINA, A. Koroshchenko - m.: Intelekt-centar, 2009. Ege-2010: Hemija / Fiii Autori-prevodioci: A.. Koroshchenko, mg Snastina - m.: Astrel, 2009. Ege-2010. Federalna banka za ispitivanje materijala (otvoreni segment). Kemijski / FIPI Autori Kompateli: A.A. Pečnica. Yu.n. Medvedev, D.YU. Doblotin - m.: Eksmo, 2009. Država konačna certifikacija diplomiranih gredara u novom obliku. Hemija. 2010 / FIPI Autori Kompateli: O.YU. Goncharuk, D.YU. Doblotin, A.A. Cayry - m.: Intelekt centar, 2009. Hemija. Tipične greške prilikom obavljanja zadataka jedinstvenog državnog ispita / fiii autora: A.A. Pečnica. Yu.n. Medvedev, D.YU. Doblotin - m.: Ruska reč, 2009.
GIA-2010. Ispit u novom obliku. Hemija. 9. razreda / FIPI Autori prevodilaca: A.A. Kaverina, D.YU. Doblotin - m.: Astrel, 2009. Država konačna certifikacija (na novom obliku): 9. razred. Tematski zadaci obuke. Chemistry / Fipi Autor Comiler: D.YU. Doblotin - m.: Eksmo, 2009. Jedinstveni državni ispit 2010. Hemija. Materijali za obuku za obuku studenata / Fiii autori-prevoditelji: yu.n. Medvedev, A.A.KAVERYINA, A. Koroshchenko - m.: Intelekt-centar, 2009. Ege-2010: Hemija / Fiii Autori-prevodioci: A.. Koroshchenko, mg Snastina - m.: Astrel, 2009. Ege-2010. Federalna banka za ispitivanje materijala (otvoreni segment). Kemijski / FIPI Autori Kompateli: A.A. Pečnica. Yu.n. Medvedev, D.YU. Doblotin - m.: Eksmo, 2009. Država konačna certifikacija diplomiranih gredara u novom obliku. Hemija. 2010 / FIPI Autori Kompateli: O.YU. Goncharuk, D.YU. Doblotin, A.A. Cayry - m.: Intelekt centar, 2009. Hemija. Tipične greške prilikom obavljanja zadataka jedinstvenog državnog ispita / fiii autora: A.A. Pečnica. Yu.n. Medvedev, D.YU. Doblotin - m.: Ruska reč, 2009.
Slide 3.
 Možete naučiti korisne informacije sa različitih web lokacija i informativnih portala O EGE: http://www.ege.spb.ru - EGE u Sankt Pederburgu Federalni zavod za pedagošku mjere http://www.fipi.ru Federal Portal "Rusko obrazovanje "http://www.edu.ru Portal informacija EGE http://www.ege.edu.ru Informacijsku podršku web lokacija EGE računarskog obrasca http://www.ege.ru Federalna služba za nadzor obrazovanja i obrazovanje i nauka http://www.obrnadzor.gov.ru na otvorenom http://www.dospo.ru Centar za intenzivne obrazovne tehnologije http://www.doportal.ru Projekt "Početna osobina" http: // www .school4you.ru Sljedeći slajd
Možete naučiti korisne informacije sa različitih web lokacija i informativnih portala O EGE: http://www.ege.spb.ru - EGE u Sankt Pederburgu Federalni zavod za pedagošku mjere http://www.fipi.ru Federal Portal "Rusko obrazovanje "http://www.edu.ru Portal informacija EGE http://www.ege.edu.ru Informacijsku podršku web lokacija EGE računarskog obrasca http://www.ege.ru Federalna služba za nadzor obrazovanja i obrazovanje i nauka http://www.obrnadzor.gov.ru na otvorenom http://www.dospo.ru Centar za intenzivne obrazovne tehnologije http://www.doportal.ru Projekt "Početna osobina" http: // www .school4you.ru Sljedeći slajd
Slide 4.

Slide 5.
 Predmet imena učitelja Broj diplomiranih diplomiranih srednjih rezultata predao je ovaj predmet prekriven minimalni prag praga prag praga za gimnaziju br. 67 od centra mjesta S. B. Lvova 2 2.100% 70 51.6
Predmet imena učitelja Broj diplomiranih diplomiranih srednjih rezultata predao je ovaj predmet prekriven minimalni prag praga prag praga za gimnaziju br. 67 od centra mjesta S. B. Lvova 2 2.100% 70 51.6
Slide 6.

Slide 7.

Slide 8.
 Imenik se sastoji od nekoliko odjeljaka priprema se za ispit na svim stranama: znanje o programu, sposobnost pravilnosti ispunjavanja i rješavanja ispita, obuka u odluci ispita.
Imenik se sastoji od nekoliko odjeljaka priprema se za ispit na svim stranama: znanje o programu, sposobnost pravilnosti ispunjavanja i rješavanja ispita, obuka u odluci ispita.
Slajd 9.

Klade 10.
 U kojoj od mogućnosti odgovora, ugljikovodici se nalaze redoslijedom smanjenja komunikacije: 1) acetilen, etan, etilen, benzene 2) etan, etan, acetilen, benzene 3) etan, etilen, benzen, acetilen 4) etan , benzen, etilen, acetilen molar benzen Masa alkine s brojem ugljičnih atoma, jednaka n, može se izračunati formulom: 1) 12n-2 2) 14n + 2 3) 14n-2 4) 12n + 2
U kojoj od mogućnosti odgovora, ugljikovodici se nalaze redoslijedom smanjenja komunikacije: 1) acetilen, etan, etilen, benzene 2) etan, etan, acetilen, benzene 3) etan, etilen, benzen, acetilen 4) etan , benzen, etilen, acetilen molar benzen Masa alkine s brojem ugljičnih atoma, jednaka n, može se izračunati formulom: 1) 12n-2 2) 14n + 2 3) 14n-2 4) 12n + 2
Klade 11.
 Koji od ugljikohidrata ne može dobiti reakciju dehidrogenacije: 1) 2,3 dimetilpenan 2) buten 2 3) 2-metilbutadiene-1,3 4) benzole 4. Odaberite sinonimni koncept termina "reaktimatizacija" 1) reforme 2) frakcioniranje Destilacija 3) Aromatizacija 4) Izomerizacija
Koji od ugljikohidrata ne može dobiti reakciju dehidrogenacije: 1) 2,3 dimetilpenan 2) buten 2 3) 2-metilbutadiene-1,3 4) benzole 4. Odaberite sinonimni koncept termina "reaktimatizacija" 1) reforme 2) frakcioniranje Destilacija 3) Aromatizacija 4) Izomerizacija
Slajd 12.
 5. Radikalna relativna molekularna težina ima radikal: vinil allyl amil benzil 6. Koji ugljen je najzapisniji: 1) metan 2) ethan 3) ethen 4) acetilen 7. Rudarstvo se naziva preradom uglja: destilacija pucanjem koks s destilacijom
5. Radikalna relativna molekularna težina ima radikal: vinil allyl amil benzil 6. Koji ugljen je najzapisniji: 1) metan 2) ethan 3) ethen 4) acetilen 7. Rudarstvo se naziva preradom uglja: destilacija pucanjem koks s destilacijom
Slide 13.
 Također u priručniku postoji detaljan opis svakog od poznatih hemijskih elemenata. Na primjer: hlor je 11. mjesto u prevladavi u litosferi. Formira najvažnije minerale: Sylvin, Sylvinit, Carnallit, Cainit itd. Primanje. U industriji se klor dobija elektrolizom rješenja ili topljenje natrijum-hlorida u laboratoriji hlora dobiven je interakcijom klorovodične kiseline jakim oksidantima. Cl 17 35.454 hlor
Također u priručniku postoji detaljan opis svakog od poznatih hemijskih elemenata. Na primjer: hlor je 11. mjesto u prevladavi u litosferi. Formira najvažnije minerale: Sylvin, Sylvinit, Carnallit, Cainit itd. Primanje. U industriji se klor dobija elektrolizom rješenja ili topljenje natrijum-hlorida u laboratoriji hlora dobiven je interakcijom klorovodične kiseline jakim oksidantima. Cl 17 35.454 hlor
Slide 14.
 Nekretnine. Žuti-zeleni gas sa oštrim ublažanim mirisom, vrlo otrovnim, gotovo 2,5 puta teže od zraka. Umjereno rastvorljivo u vodi: 3 jačina hlora u 1 volumena vode. U ovom slučaju postoji djelomična hemijska interakcija s vodom, ali većina rastvorenog hlora prisutna je u obliku molekula. Ovo rješenje poziva na hlorsku vodu. Klor izlaže snažne oksidativne svojstva u reakcijama i jednostavnim metalima i nemetalnim tvarima i kompleksom. Upotreba hlora i njegovih aplikacija za spojeve. Klor se široko koristi u proizvodnji hlorganskih spojeva (na primjer, vinil hlorid i njegov polimer, hloropyrozni krastavac, dikloroetan, perhloretilen), anorganski kloridi, za pročišćavanje vode.
Nekretnine. Žuti-zeleni gas sa oštrim ublažanim mirisom, vrlo otrovnim, gotovo 2,5 puta teže od zraka. Umjereno rastvorljivo u vodi: 3 jačina hlora u 1 volumena vode. U ovom slučaju postoji djelomična hemijska interakcija s vodom, ali većina rastvorenog hlora prisutna je u obliku molekula. Ovo rješenje poziva na hlorsku vodu. Klor izlaže snažne oksidativne svojstva u reakcijama i jednostavnim metalima i nemetalnim tvarima i kompleksom. Upotreba hlora i njegovih aplikacija za spojeve. Klor se široko koristi u proizvodnji hlorganskih spojeva (na primjer, vinil hlorid i njegov polimer, hloropyrozni krastavac, dikloroetan, perhloretilen), anorganski kloridi, za pročišćavanje vode.
Slide 15.
 Hemija je jedna od najvažnijih nauka! Bez njega je nemoguće djelovati na prirodnom naučnom univerzitetu naše zemlje. Uspješna isporuka upotrebe u 11. razred zalog je prijema u pristojnom institutu!
Hemija je jedna od najvažnijih nauka! Bez njega je nemoguće djelovati na prirodnom naučnom univerzitetu naše zemlje. Uspješna isporuka upotrebe u 11. razred zalog je prijema u pristojnom institutu!