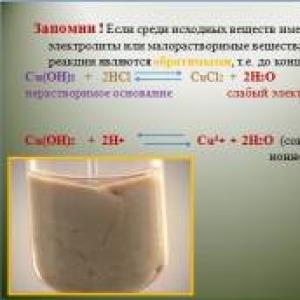
Готуємося до ЄДІ з хімії. Презентація.Позітівний досвід з підготовки до ОГЕ і ЄДІ з хімії Тематика контрольних робіт, включених в посібник
Пропоную Вашій увазі підбірку тестових завдань для підготовки до ЄДІ-2016. Завдання частини 1, №32 на перевіряється елемент змісту курсу хімії "Характерні хімічні властивості неорганічних речовин". Матеріал містить 27 тестових завдань. Відповіді додаються.
Пропоную Вашій увазі підбірку тестових завдань для підготовки до ЄДІ-2016. Завдання типу А15 на перевіряється елемент змісту курсу хімії "Характерні хімічні властивості альдегідів, граничних карбонових кислот, складних ефірів. Біологічно важливі речовини: жири, вуглеводи (моносахариди, дисахариди, полісахариди)". Матеріал містить 30 тестових завдань. Відповіді додаються.
Цільова аудиторія: для 11 класу
Освітній ресурс призначений для випускників початкової і середньої школи, які обрали випробування з предмета "хімія". Містить теоретичний матеріал по заявленій темі. Є завдання для самостійного закріплення теоретичного матеріалу і контрольний тест. Можна використовувати і в процесі викладання предмета в 9,11 класах.

Цільова аудиторія: для вчителя
Пропоную Вашій увазі підбірку тестових завдань для підготовки до ЄДІ-2016. Завдання типу А14 на перевіряється елемент змісту курсу хімії "Характерні хімічні властивості граничних одноатомних і багатоатомних спиртів, фенолу". Матеріал містить 25 тестових завдань. Відповіді додаються.
Цільова аудиторія: для 11 класу
Пропоную Вашій увазі підбірку тестових завдань для підготовки до ЄДІ-2016. Завдання типу А13 на перевіряється елемент змісту курсу хімії "Характерні хімічні властивості вуглеводнів: алканів, циклоалканов, алкенов, диенов, алкинов, ароматичних вуглеводнів (бензолу, толуолу)". Матеріал містить 25 тестових завдань. Відповіді додаються.
Цільова аудиторія: для 11 класу
Посібник призначений для відпрацювання практичних умінь і навичок учнів при підготовці до ЗНО. В роботі представлені приклади варіантів завдань частини С1, С2 з відповідями. А також ланцюжки перетворень на прикладі лужних металів і їх з'єднань з відповідями, завдання з рішенням. Посібник призначений для вчителів, учнів 11 класів.
Цільова аудиторія: для 11 класу
НХімія займає важливе місце в системі шкільної освіти.
При вивченні хімії переважно використовується описова частина курсу. Кількісні закономірності розглядаються не систематично. Уміння вирішувати розрахункові завдання є одним з показників рівня розвитку хімічного мислення школярів.
Якщо недостатньо уваги приділяти цьому важливому питанню, то, як показують перевірочні контрольні роботи, олімпіади, вступні іспити, учні слабо вирішують розрахункові завдання з хімії.
Вихід зі становища - правильне використання завдань в навчальному процесі. Неприпустимий епізодичний характер навчання рішенню розрахункових завдань.


Цільова аудиторія: для 11 класу
Дмитро Юрійович Добротін, с.н.с. лабораторії дидактики хімії Ісмоїла РАО, к.п.н. сайт
слайд 2
Структура шкільної хімічної освіти
1. Пропедевтичний етап (1 - 7 класи) 2. Основна (базова) підготовка учнів з хімії (8 - 9 класи) 3. Профільна підготовка учнів з хімії (10 - 11 класи)
слайд 3
пропедевтичний етап
Навколишній світ (1 4 класи) Природознавство (5 клас) Природознавство (5, 6, 7 класи) Фізика і Хімія (5 - 6 класи) Введення в хімію (7 клас)
слайд 4
Книга для читання
Розрахована на дітей 6 -12 років
слайд 5
Основні ідеї книги
Як влаштований світ? Методи пізнання природи Речовини навколо нас Реакції навколо нас Побутова хімічна грамотність
слайд 6
Основна школа
Контрольні роботи в новому форматі Тематичні контрольні роботи з хімії для 8 класу
слайд 7
Тематика контрольних робіт, включених в посібник
1. Початкові хімічні поняття 2. Кисень. Оксиди 3. Водень. Вода. Розчини 4. Основні класи неорганічних сполук 5. Періодичний закон і періодична система хімічних елементів Д. І. Менделєєва. Хімічна зв'язок 6. Підсумкова контрольна робота
слайд 8
Державна підсумкова атестація випускників в новій формі з хімії
Про нову форму державної підсумкової атестації в 9 класі з хімії Рекомендації для підготовки до ДПА з хімії Завдання для самостійної роботи по змістовним блокам Тренувальні варіанти Відповіді на завдання Кодифікатор
слайд 9
Стара школа
ЄДІ. Універсальні матеріали для підготовки учнів Єдиний державний іспит Рекомендації для підготовки до ЄДІ з хімії Завдання для самостійної роботи по змістовним блокам Тренувальні варіанти Відповіді на завдання Демонстраційний варіант План екзаменаційного варіанти ЄДІ
слайд 11
Посібники видавництва «Інтелект-Центр»
Призначені для використання на всіх етапах хімічної підготовки учнів Завдання, включені в допомоги, спрямовані на перевірку знань і умінь, оволодіння якими передбачено Обов'язковою мінімумом і Вимогами до рівня підготовки випускників Можуть служити доповненням до будь-якого УМК з хімії в якості дидактичних матеріалів Дозволяють відпрацьовувати матеріал різного рівня складності відображають логіку міркувань при виконанні завдань різного типу і рівнів складності Дозволяють вибудовувати індивідуальну траєкторію при відпрацюванні матеріалу в рамках підготовки до контрольних заходів, в тому числі ДПА і ЄДІ
Подивитися всі слайди
Братякова С.Б.
Підготовка до ЄДІ з хімії завдання частина 1, частина 2

Братякова С.Б.
цілі:
- Ознайомитися з матеріалом екзаменаційної роботи по хімії.
- Перевірити свою підготовленість до іспиту.
- Розширити досвід виконання тестових завдань з хімії

У презентації представлені завдання з двох частин:
- Щоб вибрати правильну відповідь на запитання частини 1 наведіть курсор на обираний відповідь і натисніть ліву кнопку мишки, при правильній відповіді з'явиться слово «Вірно», при неправильному - «Невірно»
Відповіді та рішення завдань частини 2 з'являться після клацання
таблиця Менделєєва
Таблиця розчинності

Братякова С.Б.
Чи вірні наступні судження про синтез метанолу і аміаку в промисловості?
А. Реакції синтезу метанолу і аміаку екзотермічні. Б. У виробництві метанолу і аміаку застосовується циркуляційний
1) вірні обидва судження
вірно
2) оби судження невірні
невірно
3) вірно тільки Б
невірно
4) вірно тільки А
невірно

Братякова С.Б.
Яку масу оксиду кальцію необхідно взяти для приготування 200 г розчину гідроксиду кальцію з масовою часткою 3,7%?
1) 2,8 г
невірно
2) 4,2 г
невірно
вірно
3) 5,6 г
4) 8,4 г
невірно

Братякова С.Б.
В результаті реакції, термохімічне рівняння якої
2С 2 Н 2 + 5О 2 \u003d 4СО 2 + 2Н 2 Про + 2610 кДж.
Виділилося 652,5 кДж теплоти.
Обсяг згорілого ацетилену дорівнює
1) 33,6 л
невірно
2) 22,4 л
невірно
вірно
3) 11,2 л
4) 5,6 л
невірно

Братякова С.Б.
Скільки літрів кисню потрібно для каталітичного окислення 100 л оксиду сірки (IV) до оксиду сірки (VI)? Обсяги газів виміряні за однакових умов
вірно
невірно
невірно
невірно

Установіть відповідність між назвою речовини і класом (групою) неорганічних сполук, до якого воно належить
Братякова С.Б.
назва речовини
класи з'єднань
- А) CH 3 OCH 3
- Б) HOCH 2 CH 2 CH 3
- В) HCOOCH 2 CH 3
- Г) CH 3 C (OH) 2 CH 3
- 1) алкен
- 2) одноатомний спирт
- 3) багатоатомний спирт
- 4) простий ефір
- 5) складний ефір
невірно
вірно
невірно
невірно

Установіть відповідність між назвою речовини і ступенем окислення вуглецю
Братякова С.Б.
речовини ступінь окислення С
А) метанол 1) –4
Б) метанова кислота 2) -3
В) метан 3) –2
Г) етан 4) 0
невірно
невірно
невірно
вірно

Установіть відповідність між речовиною і продуктом на аноді при електролізі його розчину
Братякова С.Б.
формула солі продукт на аноді
А) Na 2 CO 3 1) H 2 S
Б) Na 2 S 2) Cu
В) NaNO 3 3) O 2
Г) CuCl 2 4) Cl 2
6) CO 2
невірно
вірно
невірно
невірно

Установіть відповідність між формулою солі і її здатністю до гідролізу.
Братякова С.Б.
ставлення до гідролізу
1) по катіону
формула солі
1) Al 2 S 3
2) за аніоном
3) по катіону і аніону
2) K 2 SO 3
4) гідролізу не береться
3) CrCl 3
4) K 2 SO 4
невірно
вірно
невірно
невірно

Установіть відповідність між реагентом і продуктом реакції
Братякова С.Б.
продукти
1) СаСО 3
2) СаСО 3 + Н 2 Про
3) Са (НСО 3 ) 2
4) Са (НСО 3 ) 2 + Н 2 Про
5) СО + Н 2
6) Н 2 CO 3
реагенти
А) СО 2 + Н 2 Про
Б) СО 2 + СаО
В) СО 2 + Са (ОН) 2
Г) СО 2 (Із6иток) + Са (ОН) 2
невірно
невірно
невірно
вірно

Братякова С.Б.
Установіть відповідність між двома речовинами і реактивом, за допомогою якого можна розрізнити ці речовини:
речовини Реактив
А) бутанон-2 і етанол 1) HCl (р-р)
Б) гексен-1 і етілформіат 2) FeCl 3 (Водн)
В) анілін і фенол 3) Br 2 (Водн.)
Г) бензол і анілін 4) Na
5) HNO 3
невірно
вірно
невірно
невірно

Як для бензолу, так і для стиролу характерні
Братякова С.Б.
1) наявність в молекулі сполученої електронної системи
2) sp 3 гібридизація атомів вуглецю
3) взаємодія з воднем в присутності каталізатора
4) знебарвлення бромної води
5) горючість
6) хороша розчинність в воді
невірно
невірно
вірно
невірно

Метанол вступає в реакції з
Братякова С.Б.
- CH 3 COOH
- NaOH
- Ag 2 O (NH 3 )
- Br 2 (H 2 O)
- KMnO 4 (H +)
невірно
вірно
невірно
невірно

І анілін, і диметиламин реагують з
Братякова С.Б.
1 ) водою
2) брометаном
3) сірчаною кислотою
4) бромоводородом
5) гідроксидом натрію
6) розчином перманганату калію
невірно
невірно
вірно
невірно
 N +2 окислювач 2I - + 2e - - I 2 відновник "width \u003d" 640 "
N +2 окислювач 2I - + 2e - - I 2 відновник "width \u003d" 640 " Братякова С.Б.
30. Використовуючи метод електронного балансу, складіть рівняння реакції:
NaNO 2 + NaI + ... \u003d NO + ... + Na 2 SO 4 +...
Визначте окислювач і відновник.
Відповідь: 2NaNO 2 + 2NaI + 2H 2 SO 4 \u003d 2NO + I 2 + 2Na 2 SO 4 + 2H 2 O
N +3 + e - - N +2 окислювач
2I - + 2e - - I 2 відновник

31. Мідь розчинили в концентрованої сірчаної кислоти. Отриману сіль обробили надлишком розчину гідроксиду натрію.
Випав блакитний осад відфільтрували і прожарили. Потім, отримане речовина прожарили з вугіллям.
Напишіть рівняння чотирьох описаних реакцій .
Братякова С.Б.
Відповідь: 1) Сu + 2H 2 SO 4 конц. \u003d CuSO 4 + SO 2 + 2H 2 O
2) CuSO 4 + 2NaOH \u003d Na 2 SO 4 + Cu (OH) 2
3) Cu (OH) 2 \u003d CuO + H 2 O
4) 2CuO + C \u003d 2Cu + CO 2

32. Напишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення .
Братякова С.Б.
(+ H 2 O) 1500 0 З САКТІ. t 0 (+ Br 2 ), AlBr 3 (+ NH 3 ), T 0 , p
Al 4 C 3 → Х 1 → Х 2 → Х 3 → Х 4 → X 5
Al 4 C 3 + 12H 2 O → 3CH 4 + 4Al (OH) 3
2CH 4 → C 2 H 2 + 3H 2
3C 2 H 2 → C 6 H 6
C 6 H 6 + Br 2 → C 6 H 5 Br + HBr
C 6 H 5 Br + 3NH 3 → C 6 H 2 Br (NH 2 ) 3 + 3H 2

33. Сірководень, що виділився при взаємодії надлишку концентрованої сірчаної кислоти з 1,44 г магнію, пропустили через 160 г 1,5% -ного розчину брому. Визначте масу випав при цьому осаду
Братякова С.Б.
1) 5H 2 SO 4конц. + 4Mg \u003d 4MgSO 4 + H 2 S + 4H 2 O
Br 2 + H 2 S \u003d 2HBr + S
2) n (Mg) \u003d 1,44 / 24 \u003d 0,06 (моль)
n (H 2 S) \u003d 0,015 (моль)
n (Br 2 ) \u003d 160⋅0,015 / 160 \u003d 0,015 (моль) (обидві речовини реагують повністю)
3) n (H 2 S) \u003d n (Br 2 ) \u003d N (S) \u003d 0,015 (моль)
m (S) \u003d 32г / моль 0,015 моль \u003d 0,48г
Відповідь: маса осаду \u003d 0,48 м

34. При взаємодії 11,6 г граничного альдегіду з надлишком гідроксиду міді (II) при нагріванні утворився осад масою 28,8 г. Виведіть молекулярну формулу альдегіду. Запишіть структурну формулу і рівняння реакції
Братякова С.Б.
1) З n H 2n O + Cu (OH) 2 \u003d С n H 2n + 1 O 2 + H 2 O + Cu 2 O
2) n (Cu 2 O) \u003d 28,8 / 144 \u003d 0,2 (моль)
n (Cu 2 O) \u003d n (С n H 2n O) \u003d 0,2 моль
М (С n H 2n O) \u003d 11,6 / 0,2 \u003d 58 г / моль
3) М (С n H 2n O) \u003d 12n + 2n + 16 \u003d 58
14n + 16 \u003d 58, 14n \u003d 42, n \u003d 3
Молекулярна формула - C 3 H 6 O - пропаналь

Братякова С.Б.

Братякова С.Б.

Братякова С.Б.
література:
1 . Відкритий банк завдань ЄДІ http://www.fipi.ru/os11/xmodules/qprint/afrms.php?proj =
2. http://chem.reshuege.ru/test?theme\u003d20
3. http://www.otbet.ru/ege/demo-varianty-ege/demo-himiya/
4. О.С. Габрієлян. Хімія 10 клас. Дрофа. М. 2012
5. О.С. Габрієлян. Хімія 11 клас. Дрофа. М. 2012
6. Шаблон Алексєєвої Л.А.
ЕТАПИ ПІДГОТОВКИ УЧНІВ До ЄДІ ПО ХІМІЇ п / пп / п Зміст етапу період 1 Формування: інтересу до предмета і мотивації його вивчення; міцних базових знань; умінь самостійно працювати з літературою, систематично займатися вирішенням завдань; умінь працювати з тестами різних типів. 8-9класс

ЕТАПИ ПІДГОТОВКИ УЧНІВ До ЄДІ ПО ХІМІЇ п / пп / п Зміст етапу період 2 Профільна орієнтація учнів Визначення кола предметів, за якими необхідна підготовка до ЄДІ Формування групи учнів, яким необхідна підготовка до ЗНО з хімії 9-10класс

ЕТАПИ ПІДГОТОВКИ УЧНІВ До ЄДІ ПО ХІМІЇ п / пп / п Зміст етапу період 3 Поглиблена підготовка групи учнів з хімії: диференційований підхід на уроках курси за вибором індивідуальні консультації клас

ЕТАПИ ПІДГОТОВКИ УЧНІВ До ЄДІ ПО ХІМІЇ п / пп / п Зміст етапу період 4 Безпосередня підготовка до іспиту: знайомство з структурою КІМ по хімії, нормативними документами; виділення особливо складних тем, підбір завдань різного рівня складності на ці теми; вивчення матеріалу за темами, при цьому: - повторення теорії; - самостійна робота з завданнями ЄДІ, що відносяться до даної теми; - розбір всього незрозумілого і невирішеного. 11 клас


РОБОТА З БАТЬКАМИ Метою роботи: усвідомлення певної їх частиною того факту, що для реалізації життєвих цілей їх дітьми їм необхідна поглиблена природничо підготовка. Федеральний стандарт базового рівня не передбачає за мету підготовки учнів до вступу до вузу за цим напрямком. Учень, що вибирає цей іспит, повинен планувати великий обсяг самостійної роботи на уроках. Звернути увагу батьків на роль їх допомоги в підготовці своїх дітей. Учитель повинен розповісти і про ту допомогу, яку він здатний надати учням в їх роботі (матеріали, консультації).

ДИФЕРЕНЦІЙОВАНИЙ ПІДХІД НА УРОКАХ Підготовка до ЄДІ невеликої групи учнів. Учитель повинен підготувати завдання більш високого рівня, завдання в форматі ЄДІ. Учитель пропонує додатковий вільний домашнє завдання. Залучення цих учнів в якості помічників вчителя, тьюторів при організації взаимообучения і взаємоконтролю в навчальному процесі.

САМОСТІЙНА РОБОТА УЧНІВ Частина тестів для самостійної роботи може даватися учням з готовими відповідями. Виконуючи такі тести, учень звіряє свої відповіді з «ключем», зазначає допущені помилки. Потім він повинен проаналізувати їх. Особливим значком відзначаються помилки, допущені через неуважність, особливим - ті, які вдалося виправити за допомогою посібника, особливим - ті, які учень не зміг зрозуміти. Результати цього розбору учень показує вчителю на співбесідах-консультаціях або в будь-який зручний час. Можуть бути і контрольні тести, які перевіряються безпосередньо на консультаціях.

МЕТОДИКА ВИКОРИСТАННЯ Теско НА УРОКАХ Для успішної роботи на ЄДІ і на інших видах контролю в аналогічному форматі, учні повинні знати основні види тестових завдань, орієнтуватися в їх структурі, розуміти, в якій формі потрібно давати свою відповідь. У тесті, особливо короткому, завжди є можливість отримання незаслуженої оцінки за рахунок вгадування. При їх використанні не розвивається усна і письмова мова учня.

МЕТОДИКА ВИКОРИСТАННЯ Теско НА УРОКАХ Прийом роботи з тестами - «Відповідь з коментарями»: Учень, усно або письмово виконуючи завдання тесту, не просто вказує правильну відповідь, але і коментує його, дає мотивування свого вибору. Мотивуванням може служити словесне пояснення з опорою на властивості певного класу речовин, формулювання визначення, правила, закону, складання рівняння реакції, рішення розрахункової завдання ...

ОСОБЛИВОСТІ ПІДГОТОВКИ СИЛЬНИХ УЧНІВ Метою підготовки до ЄДІ для сильних учнів є оволодіння практичними навичками виконання найбільш складних завдань частини С. Однак вони повинні регулярно тренувати себе на виконанні завдань частини А і В. При цьому перед ними ставляться завдання: а) звести до мінімуму помилки, яких припускаються через неуважність; б) виявити ті теми курсу хімії, де помилки допускаються через незнання, вивчити ці розділи, відпрацювати отримані знання на тематичних тестах.

ПІДГОТОВКА слабких І СЕРЕДНІХ УЧНІВ Орієнтована на успішну здачу ЄДІ як мінімум на задовільну оцінку. Для цього досить упевненого виконання частини А контрольно-вимірювальних матеріалів (30 первинних балів, які можна набрати в частині А, приблизно відповідають 50 балам за шкалою ЄДІ). Підготовку треба вести по найхарактернішим властивостями речовин, найбільш поширених типів реакцій, найпростішим і найчастіше використовуваним алгоритмам розв'язання задач.

СТРАТЕГІЯ РОБОТИ НА ІСПИТІ Правила першого кола: Відзначай вірне і пропускай складне. (45хв.) Правила другого кола: Перевіряй зроблене, відкидай невірне, використовуй «три шпаргалки» і закони хімії. (95мін.) Правило третього кола: Перевіряй зроблене і вгадує незнайдене .


Cлайд 1
Cлайд 2
 ДПА-2010. Іспит в новій формі. Хімія. 9 клас / ФІПІ автори укладачі: А.А. Каверіна, Д.Ю. Добротін - М .: Астрель, 2009. Державна підсумкова атестація (за новою формою): 9 клас. Тематичні тренувальні завдання. Хімія / ФІПІ автор упорядник: Д.Ю. Добротін - М .: Ексмо 2009 Єдиний державний іспит 2010. Хімія. Навчально-тренувальні матеріали для підготовки учнів / ФІПІ автори-упорядники: Ю.М. Медведєв, А.А.Каверіна, А.С. Корощенко - М .: Інтелект-Центр, 2009. ЄДІ-2010: Хімія / ФІПІ автори-упорядники: А.С. Корощенко, М.Г. Снастіна - М .: Астрель, 2009. ЄДІ-2010. Федеральний банк екзаменаційних матеріалів (відкритий сегмент). Хімія / ФІПІ автори укладачі: А.А. Каверіна. Ю.Н. Медведєв, Д.Ю. Добротін - М .: Ексмо, 2009. Державна підсумкова атестація випускників 9 класів в новій формі. Хімія. 2010 / ФІПІ автори укладачі: О.Ю. Гончарук, Д.Ю. Добротін, А.А. Каверіна - М .: Інтелект-Центр, 2009. Хімія. Типові помилки при виконанні завдань Єдиного державного іспиту / ФІПІ автори: А.А. Каверіна. Ю.Н. Медведєв, Д.Ю. Добротін - М .: Російське слово 2009.
ДПА-2010. Іспит в новій формі. Хімія. 9 клас / ФІПІ автори укладачі: А.А. Каверіна, Д.Ю. Добротін - М .: Астрель, 2009. Державна підсумкова атестація (за новою формою): 9 клас. Тематичні тренувальні завдання. Хімія / ФІПІ автор упорядник: Д.Ю. Добротін - М .: Ексмо 2009 Єдиний державний іспит 2010. Хімія. Навчально-тренувальні матеріали для підготовки учнів / ФІПІ автори-упорядники: Ю.М. Медведєв, А.А.Каверіна, А.С. Корощенко - М .: Інтелект-Центр, 2009. ЄДІ-2010: Хімія / ФІПІ автори-упорядники: А.С. Корощенко, М.Г. Снастіна - М .: Астрель, 2009. ЄДІ-2010. Федеральний банк екзаменаційних матеріалів (відкритий сегмент). Хімія / ФІПІ автори укладачі: А.А. Каверіна. Ю.Н. Медведєв, Д.Ю. Добротін - М .: Ексмо, 2009. Державна підсумкова атестація випускників 9 класів в новій формі. Хімія. 2010 / ФІПІ автори укладачі: О.Ю. Гончарук, Д.Ю. Добротін, А.А. Каверіна - М .: Інтелект-Центр, 2009. Хімія. Типові помилки при виконанні завдань Єдиного державного іспиту / ФІПІ автори: А.А. Каверіна. Ю.Н. Медведєв, Д.Ю. Добротін - М .: Російське слово 2009.
Cлайд 3
 Почерпнути корисну інформацію в повному обсязі можна з різних сайтів і інформаційних порталів про ЄДІ: http://www.ege.spb.ru - ЄДІ У Санкт - Петербурзі Федеральний інститут педагогічних вимірювань http://www.fipi.ru Федеральний портал "Російське освіту "http://www.edu.ru Портал інформаційної підтримки ЄДІ http://www.ege.edu.ru Сайт інформаційної підтримки ЄДІ в комп'ютерній формі http://www.ege.ru Федеральна служба по нагляду у сфері освіти і науки http://www.obrnadzor.gov.ru Відкритий коледж http://www.dospo.ru Центр інтенсивних технологій освіти http://www.odoportal.ru Проект "Домашнє навчання" http://www.school4you.ru наступний слайд
Почерпнути корисну інформацію в повному обсязі можна з різних сайтів і інформаційних порталів про ЄДІ: http://www.ege.spb.ru - ЄДІ У Санкт - Петербурзі Федеральний інститут педагогічних вимірювань http://www.fipi.ru Федеральний портал "Російське освіту "http://www.edu.ru Портал інформаційної підтримки ЄДІ http://www.ege.edu.ru Сайт інформаційної підтримки ЄДІ в комп'ютерній формі http://www.ege.ru Федеральна служба по нагляду у сфері освіти і науки http://www.obrnadzor.gov.ru Відкритий коледж http://www.dospo.ru Центр інтенсивних технологій освіти http://www.odoportal.ru Проект "Домашнє навчання" http://www.school4you.ru наступний слайд
Cлайд 4

Cлайд 5
 Предмет ПІБ вчителя Кількість випускників, які здавали ЄДІ Середній бал здавали даний предмет подолали мінімальний поріг відсоток подолали поріг За Гімназії №67 Загальноміський Хімія С. Б. Львова 2 + 2 100% 70 51,6
Предмет ПІБ вчителя Кількість випускників, які здавали ЄДІ Середній бал здавали даний предмет подолали мінімальний поріг відсоток подолали поріг За Гімназії №67 Загальноміський Хімія С. Б. Львова 2 + 2 100% 70 51,6
Cлайд 6

Cлайд 7

Cлайд 8
 Довідник складається з декількох розділів, що підготовляють до ЄДІ з усіх боків: знання програми, вміння правильно заповнювати і вирішувати ЄДІ, тренування в рішенні ЄДІ.
Довідник складається з декількох розділів, що підготовляють до ЄДІ з усіх боків: знання програми, вміння правильно заповнювати і вирішувати ЄДІ, тренування в рішенні ЄДІ.
Cлайд 9

Cлайд 10
 В якому з варіантів відповіді вуглеводні розташовані в порядку зменшення довжини зв'язку: 1) ацетилен, етан, етилен, бензол 2) етан, етилен, ацетилен, бензол 3) етан, етилен, бензол, ацетилен 4) етан, бензол, етилен, ацетилен Молярну масу алкінілу з числом вуглецевих атомів, рівним n, можна розрахувати за формулою: 1) 12n-2 2) 14n + 2 3) 14n-2 4) 12n + 2
В якому з варіантів відповіді вуглеводні розташовані в порядку зменшення довжини зв'язку: 1) ацетилен, етан, етилен, бензол 2) етан, етилен, ацетилен, бензол 3) етан, етилен, бензол, ацетилен 4) етан, бензол, етилен, ацетилен Молярну масу алкінілу з числом вуглецевих атомів, рівним n, можна розрахувати за формулою: 1) 12n-2 2) 14n + 2 3) 14n-2 4) 12n + 2
Cлайд 11
 Який з вуглеводів можна отримати реакцією дегідрування: 1) 2,3 діметілпентан 2) Бутен 2 3) 2-метілбутадіен-1,3 4) Бензол 4. Виберіть синонімічне поняття терміна «реактіфікація» 1) Риформинг 2) Фракційна перегонка 3) Ароматизація 4 ) ізомеризація
Який з вуглеводів можна отримати реакцією дегідрування: 1) 2,3 діметілпентан 2) Бутен 2 3) 2-метілбутадіен-1,3 4) Бензол 4. Виберіть синонімічне поняття терміна «реактіфікація» 1) Риформинг 2) Фракційна перегонка 3) Ароматизація 4 ) ізомеризація
Cлайд 12
 5.Наібольшую відносну молекулярну масу має радикал: Вініл аллил Аміл Бензил 6. Який з вуглеців горить найбільш коптящим: 1) Метан 2) Етан 3) Етен 4) Ацетилен 7.Основние процес переробки кам'яного вугілля називають: Ректифікацією крекінгу коксування Перегонкою
5.Наібольшую відносну молекулярну масу має радикал: Вініл аллил Аміл Бензил 6. Який з вуглеців горить найбільш коптящим: 1) Метан 2) Етан 3) Етен 4) Ацетилен 7.Основние процес переробки кам'яного вугілля називають: Ректифікацією крекінгу коксування Перегонкою
Cлайд 13
 Так само в посібник є докладний опис кожного з відомих хімічних елементів. Наприклад: Хлор Займає 11 місце за поширеністю в літосфері. Утворює найважливіші мінерали: сильвин, сильвініт, карналіт, каїніт та ін. Отримання. У промисловості хлор отримують електролізом розчину або розплаву хлориду натрію У лабораторії хлор отримують взаємодією соляної кислоти з сильними окислювачами. Cl 17 35,454 Хлор
Так само в посібник є докладний опис кожного з відомих хімічних елементів. Наприклад: Хлор Займає 11 місце за поширеністю в літосфері. Утворює найважливіші мінерали: сильвин, сильвініт, карналіт, каїніт та ін. Отримання. У промисловості хлор отримують електролізом розчину або розплаву хлориду натрію У лабораторії хлор отримують взаємодією соляної кислоти з сильними окислювачами. Cl 17 35,454 Хлор
Cлайд 14
 Властивості. Це жовто-зелений газ з різкими задушливим запахом, дуже отруйний, майже в 2,5 рази важчий за повітря. Помірно розчинний у воді: 3 обсягу хлору в 1 об'ємі води. При цьому відбувається часткове хімічну взаємодію його з водою, проте велика частина розчиненого хлору присутній у вигляді молекул. Такий розчин називає хлорного водою. Хлор проявляє сильні окислювальні властивості в реакціях як з простими речовинами-металами і неметалами, так і зі складними. Застосування хлору і його сполук Застосування. Хлор широко використовують у виробництві хлорорганічних сполук (наприклад, вінілхлориду та його полімеру, хлоропренного Кучука, дихлоретан, перхлоретілена), неорганічних хлоридів, для водоочищення.
Властивості. Це жовто-зелений газ з різкими задушливим запахом, дуже отруйний, майже в 2,5 рази важчий за повітря. Помірно розчинний у воді: 3 обсягу хлору в 1 об'ємі води. При цьому відбувається часткове хімічну взаємодію його з водою, проте велика частина розчиненого хлору присутній у вигляді молекул. Такий розчин називає хлорного водою. Хлор проявляє сильні окислювальні властивості в реакціях як з простими речовинами-металами і неметалами, так і зі складними. Застосування хлору і його сполук Застосування. Хлор широко використовують у виробництві хлорорганічних сполук (наприклад, вінілхлориду та його полімеру, хлоропренного Кучука, дихлоретан, перхлоретілена), неорганічних хлоридів, для водоочищення.
Cлайд 15
 Хімія - одна з найважливіших наук! Без неї не можна вступити до жодного природничо-науковий інститут нашої країни. Успішне складання ЄДІ в 11 класі - запорука надходження в пристойний інститут!
Хімія - одна з найважливіших наук! Без неї не можна вступити до жодного природничо-науковий інститут нашої країни. Успішне складання ЄДІ в 11 класі - запорука надходження в пристойний інститут!